【概要】
筋肉の分子モーターであるミオシンは、アデノシン三リン酸(ATP)をアデノシン二リン酸(ADP)と無機リン酸(Pi)に加水分解することでアクチンフィラメントを駆動する力を発生します。東北大学大学院工学研究科の最上譲二助教、東北大学大学院工学研究科/多元物質科学研究所(教育研究支援者)の鈴木誠名誉教授らは、大阪大学との共同で新たな分子間力の存在を理論的に提示し、アクチン・ミオシンの駆動の元になるエネルギー形態と力発生機構を、世界で初めて水和効果という物理的裏付けから説明することに成功しました。この新説を国際科学誌(Cytoskeleton)にこのたび発表しました。
ニュース
研究成果
筋収縮の力の起源に迫る新たな分子間力を提示
論文情報:
題目: Physical driving force of actomyosin motility based on the hydration effect
著者: Makoto Suzuki, George Mogami, Hideyuki Ohsugi, Takahiro Watanabe, and Nobuyuki Matubayasi
Journal: Cytoskeleton
DOI: 10.1002/cm.21417
【問い合わせ先】
東北大学大学院工学研究科
担当 鈴木 誠
電話:022-795-4922
makoto.suzuki.c5*tohoku.ac.jp(*を@に置き換えてください)
【詳細な説明】
水中におかれたアクチンフィラメント(F-アクチン)の表面は強く負に荷電し、周りには1メートルあたり100メガボルトに達する強い電場(上下黒矢印)が存在します。この強電場によりF-アクチン近傍の水はハイパーモバイル水(図1:HMW、黄緑色)となります。
一方、水中のATPはミオシン頭部(図1:橙色)に結合した後、ADPとPiに分解され、このときミオシン頭部がF-アクチン(図1:朱色)に結合すると、アクチン数個分の構造が変化(図1:肌色)します。その結果、アクチン周りの電場強度が下がり、近傍の水は弱いHMW(図1:薄青色)となり自由水に近づきます。
東北大学鈴木誠名誉教授、東北大学大学院工学研究科最上譲二助教、大阪大学大学院基礎工学研究科松林伸幸教授らの研究グループは、今回の研究でタンパク質の水和状態は、より強いHMW領域でエネルギー的に安定化することを発見しました。この図1の状況下ではミオシン頭部はF-アクチンと結合・解離しながら右向きに力(マゼンタ色太い矢印)を受け移動します。この駆動力の大きさを今回の新説で見積もると数ピコニュートンほどの大きさとなり、これにより筋肉収縮力を再現でき、理工学的に応用可能な新たな力の原理となります。
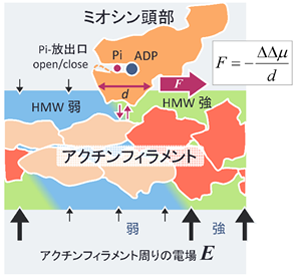
図1 アクチンフィラメント上のミオシンに働く力の新たなしくみ
分子モーターであるアクトミオシンを動かす物理的力は何か、その力を生み出す直接のエネルギー形態は何か?との問いに、これまでの研究で答えたものはまだありません。1971年にHuxley-Simmonsがパワーストローク説を提示し、その後タンパク質構造解析研究が進み、アクチン、ミオシンの精密な原子座標が解かれ、また生化学反応速度論、熱測定、さらに一分子運動観測により全体的理解は深まりました。現在では1997年にHolmesによって修正されたパワーストローク説がもっとも受け入れられています。そこでの物理的力の説明としては、ミオシン分子内のATP分解反応および反応産物放出時のミオシン分子変形によるとしていますが、このモデルの駆動力の直接のエネルギー形態は、ミオシン分子内スプリングに蓄えられた機械的エネルギーであり、そのスプリングを変形するためのエネルギーがATP加水分解エネルギーとする説明には、実験的な熱力学量測定結果と矛盾するという大問題がありました。
今回、東北大学大学院工学研究科/多元物質科学研究所の鈴木誠名誉教授らが提示した分子間力は、タンパク質分子の水和自由エネルギー(負の大きな値)が、水中の107~108 V/m という強電場のもとではさらに大きな負の量となるというこれまでタンパク質分子間の力として認識されていないまったく新しい力です。つまり、水中の巨大分子(タンパク質やDNAなど)は、より電場の強い領域に向かう新たな表面力を受けるのであるということです。これは、松林伸幸氏(大阪大学教授)と最上譲二氏(東北大学大学院工学研究科助教)と最新の手法で計算した結果によって明らかになりました。
また、筋肉のアクチンフィラメントは水中で負に荷電したフィラメントであり表面に十分な大きさの電場を形成し、周りの水はHMWとなります。アクチンフィラメントは、ミオシン分子との結合や結合したミオシン分子内のATPの分解反応にともない、その構造が変化し、近傍の水のHMW強度も変化することが今回の研究で明らかとなりました。
これらの情報を総合して、これまで得られたATP分解サイクルの反応ステップの熱力学量との整合性も保ちつつ、アクチン・ミオシンの駆動力とそのもとになるエネルギー形態の物理的実体を提示することができました。このことは、生物学の教科書に記載されている筋収縮の機構についての多くの記述を書き換えるものです。
リンク先:
東北大学
東北大学 工学研究科・工学部